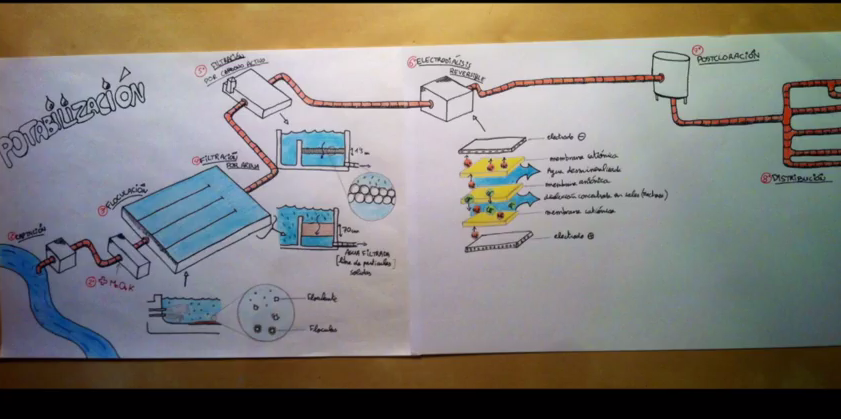
Quin gust té l’aire? Gust de nitrogen, és clar. Prop del 80% de l’aire que respirem és nitrogen, un gas que per a la major part dels organismes vius és inert, però alhora indispensable, ja que és un component fonamental tant de les proteïnes com de l’ADN. Per tal que animals i plantes puguin utilitzar-lo cal fixar el nitrogen atmosfèric; és a dir, fer-lo reaccionar per introduir-lo com a element en una espècie química que pugui ser utilitzada pels éssers vius. Però aquest procés el saben fer molt pocs microorganismes.
A principis del segle XX, es va produir un avenç científic formidable: es va aconseguir fixar el nitrogen de forma artificial. El procés Haber-Bosch, reconegut amb els premis Nobel de química de 1918 i 1931, permet obtenir amoníac (NH3), el qual és fonamental per obtenir els fertilitzants necessaris en agricultura. D’aquesta manera, les plantes tenen una font de nitrogen, i es poden mantenir els conreus necessaris per abastir a la població mundial. I així, els àtoms de nitrogen de l’aire, ara convertits en amoníac i altres derivats, queden capturats dins de les plantes i es reparteixen per la cadena tròfica. Sens dubte, tot té una petita part d’aire, fins i tot l’amanida que sovint ens posem al plat.